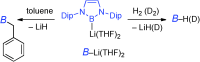(1a) ホウ素求核種ボリルアニオンの化学
有機化学において含ホウ素化合物は多様な役割を果たすことが知られているが、そのほとんどはホウ素の空のp軌道を生かしたルイス酸としての役割である。それではルイス塩基として作用するホウ素化合物は存在しないのか?
これまでに第2周期p-ブロック元素のアニオンのリチウム塩は、アルキルリチウムやリチウムアルコキシドなど、有機合成化学においてアニオン性求核剤として重要な位置を占めてきた。しかし対応するホウ素のリチウム化合物R2BLiに関してはこれまで全く報告が無く、これが存在すればボリルアニオン等価体としての利用が期待でき、有機化学・無機化学において大きなブレイクスルーになりうると考えられる。
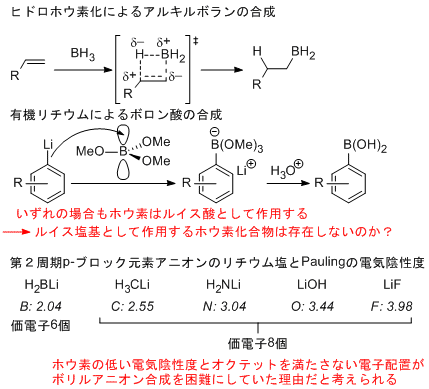
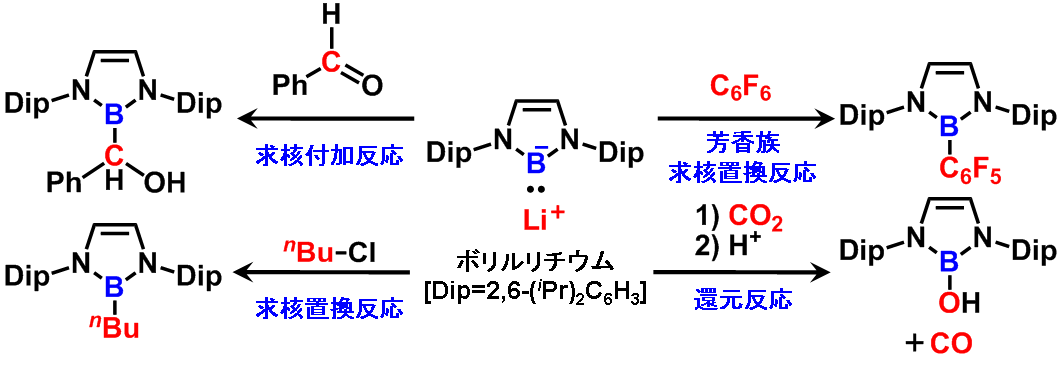
我々のグループでは最近このボリルリチウムの合成と単離に成功しており、その求核種としての興味深い性質を明らかにしている。X線結晶構造解析および密度汎関数計算により、ボリルリチウムはホウ素上に求核性を有することが予測された。実際にボリルリチウムはベンズアルデヒドに対して求核付加を起こし、対応する求核付加体を与える。また、ハロゲン化アルキルや電子不足フッ化アリールに対して求核置換反応を起こすことも明らかになっている。二酸化炭素との反応では、カルボニルに求核付加後、転位反応を経由して還元された一酸化炭素を放出する。
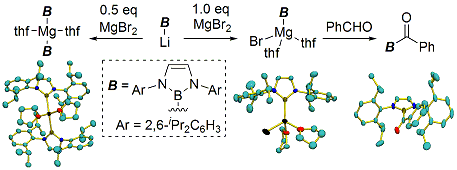
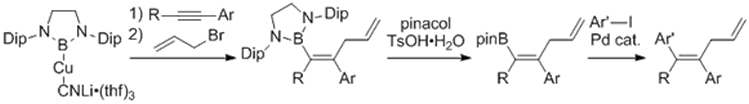
また、ボリルリチウムと金属臭化物のsalt metathesisによりボリルマグネシウム・ボリル銅・ボリル亜鉛類を合成し、これらも同様に求核性のホウ素化合物として利用できることを明らかにした。特にボリル銅化合物はアルキンに対してホウ素と炭素を同時に導入し、さらに続けて鈴木宮浦クロスカップリングを行うことができるという有機合成化学的に有用な反応の開発へとつながった。
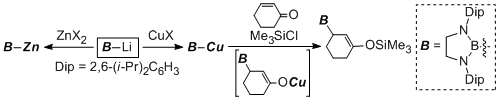
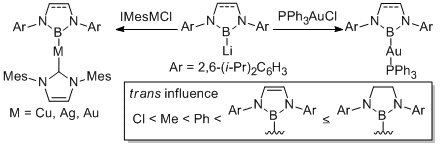
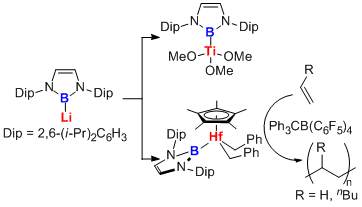
また、ボリルリチウムを遷移金属塩化物に対してもトランスメタル化することで、対応するボリル遷移金属錯体を簡便に合成することが可能になった。この試みによりボリル銀・ボリル金・ボリルチタン・ボリルハフニウム錯体をそれぞれ世界で初めて合成することができた。得られたボリル錯体のうち、ボリルハフニウム錯体に関しては助触媒と組み合わせることで、エチレンおよび1-ヘキセンの重合触媒として作用することも明らかにした。
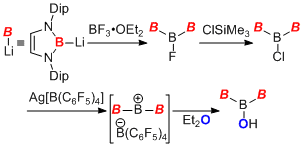
これまでにボリルアニオン類が存在しなかったことで、ホウ素置換典型元素化合物の合成は困難であったが、ボリルリチウムを用いることで、これまでに合成例のない典型元素化合物の合成にいくつか成功している。例えばボリルリチウムをボラン-THFと反応させることで、ホウ素置換ヒドロボラート種を合成単離することができ、これがヒドリドおよび水素ラジカル供与体として作用することも明らかにした。また、ボリルリチウムをBF3-OEt2と反応させることで、ホウ素原子が直鎖状に並んだ化合物トリボラン誘導体を合成することができた。ホウ素化学においてはこのような直鎖状化合物は存在そのものが珍しく、本研究が2例目となる。
ボリルアニオンは炭素よりも電気陰性度の低いホウ素原子が負電荷を有する構造であるため、その塩基性はカルボアニオンよりも高いと予測される。実際にボリルリチウムをトルエンと反応させると、酸性度が比較的低いトルエンのメチル基水素を脱プロトン化することが可能であることもわかった。また、ボリルアニオンは水素分子の脱プロトン化も可能であった。またこの脱プロトン化反応は、これまでに報告されているアルキルリチウムによる水素分子引き抜きに比べて反応が非常に速いことも明らかになり、ボリルアニオンの高い塩基性を示すことが可能となった。
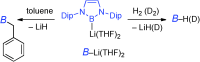
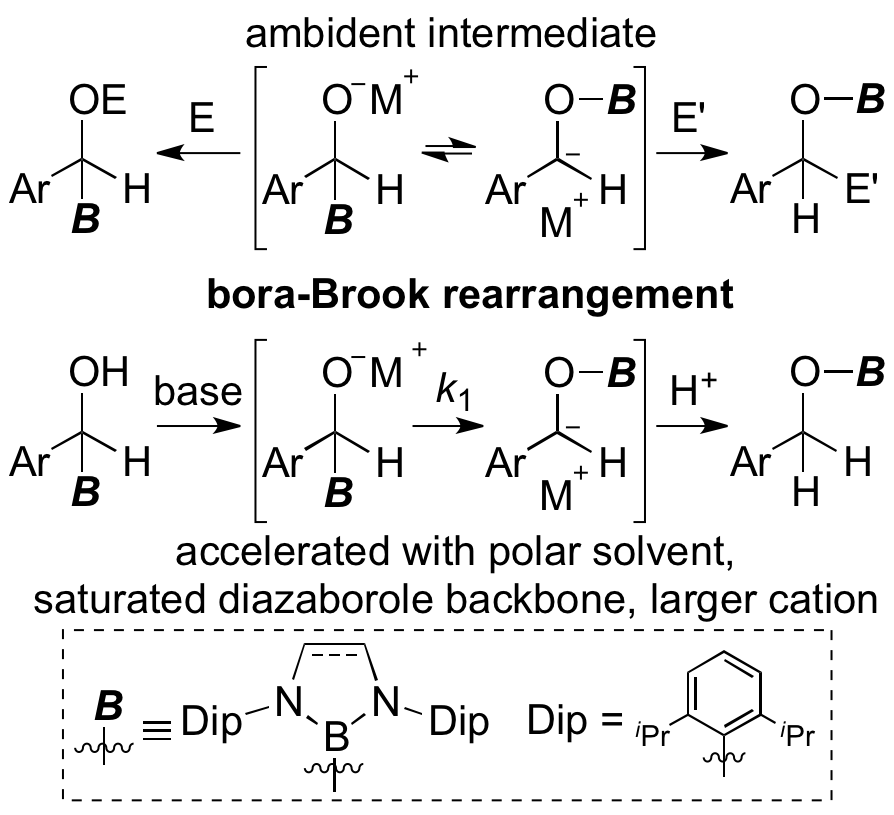
ボリルアニオンがベンズアルデヒドと反応して得られるボリルベンジルアルコールは塩基による脱プロトン化を受けるとホウ素置換基が炭素から酸素へと転位することがわかった。この転位反応はケイ素化学において知られるBrook転位反応と類似の反応形式で進行すること、その反応速度は大きなアルカリ金属カチオン、配位性溶媒、飽和炭素骨格を有するボリル基を用いた時に加速されることを明らかにした。
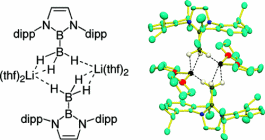
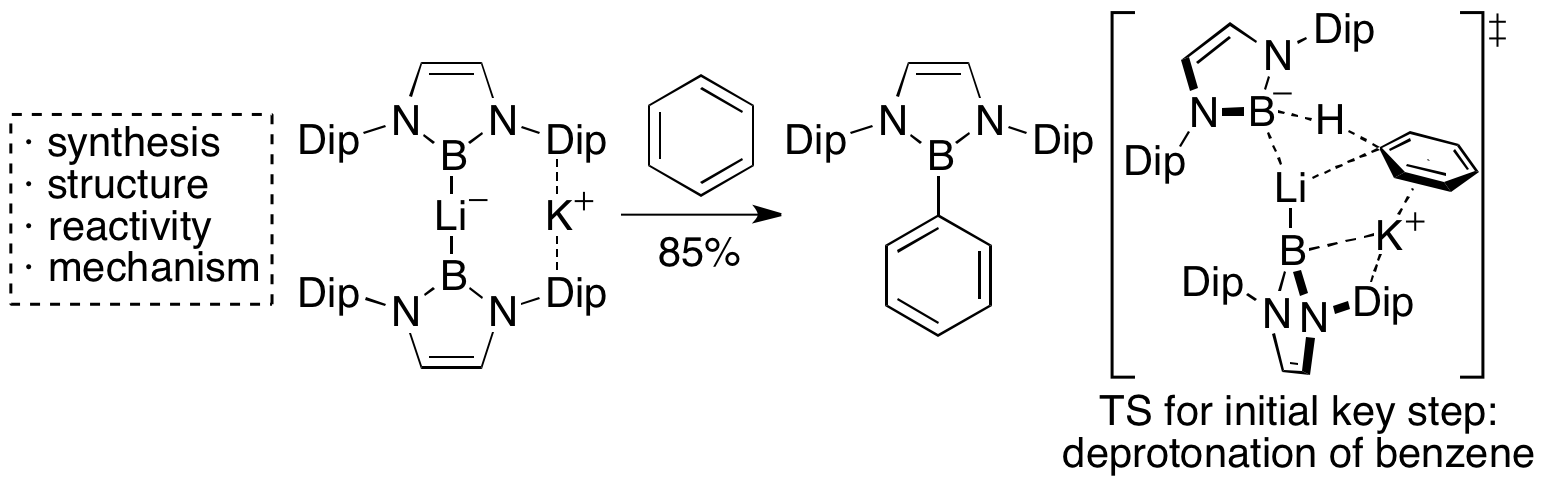
ボリルリチウムの原料であるブロモボランを単体のLiおよびNa/K合金で還元すると、ボリルアニオンがLiカチオンに2つ配位したアート型錯体が得られることが明らかになった。このジボリルリサートはπ電子を持つN-B-N型ユニットがLiカチオンに配位することで、異常に高磁場シフトした7Li NMRシグナルを示す。また、この化合物はボリルリチウムよりも高い塩基性を持ち、ベンゼンをも直接脱プロトン化可能であることを明らかにした。
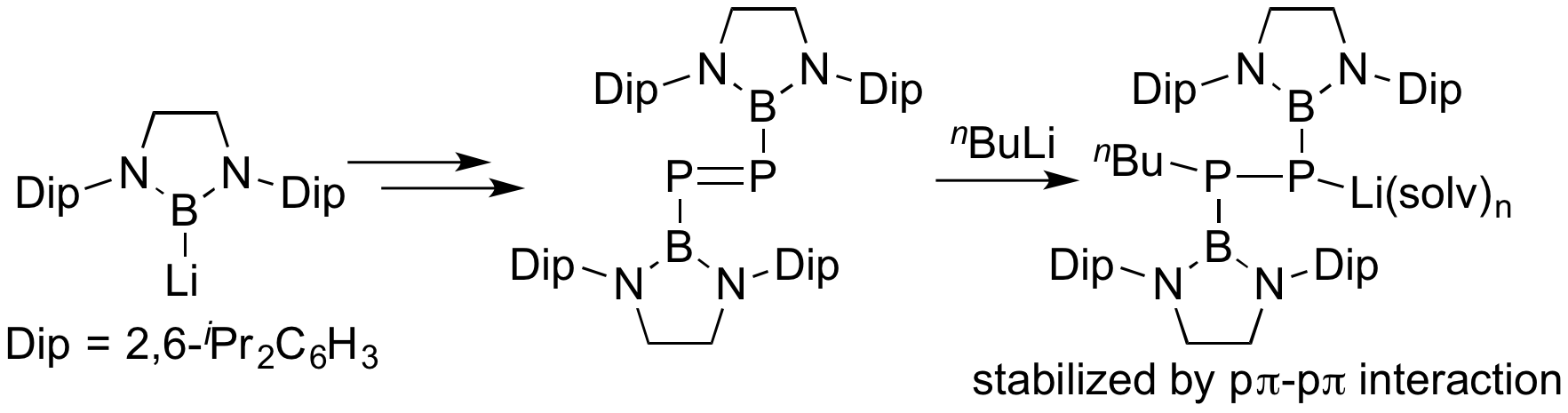
ボリルアニオンは各種ホウ素置換典型元素化合物の合成にも利用可能である。ボリルリチウムからトランスメタル化で生成したボリル亜鉛を三塩化リンと反応させ、次いでMgによる還元を行うことで、ホウ素置換基を有するP=P二重結合化合物ジホスフェンの合成に成功した。これまでに合成されてきたジホスフェンはnBuLiとの反応により不安定な付加体を与えるが、ホウ素置換ジホスフェンとnBuLiとの反応では安定な付加体を与え、その安定性はホウ素置換基のπ受容性に起因することを明らかにした。これは典型元素化学においてホウ素置換基の効果を明確に示したという点で学問的意義が大きい。
発表論文
(1) Segawa, Y.; Yamashita, M.; Nozaki, K. Science 2006, 314, 113-115. doi
(2) Yamashita, M.; Suzuki, Y.; Segawa, Y.; Nozaki, K. J. Am. Chem. Soc. 2007, 129, 9570-9571. doi.
(3) Segawa, Y.; Yamashita, M.; Nozaki, K. Angew. Chem. Int. Ed. 2007, 46, 6710-6713. doi.
(4) Segawa, Y.; Suzuki, Y.; Yamashita, M.; Nozaki, K. J. Am. Chem. Soc. 2008, 130, 16069-16079. doi
(5) Yamashita, M.; Suzuki, Y.; Segawa, Y.; Nozaki, K. Chem. Lett.2008, 37, 802-803. doi
(6) Kajiwara, T.; Terabayashi, T.; Yamashita, M.; Nozaki, K. Angew. Chem. Int. Ed. 2008, 47, 6606-6610. doi
(7) Terabayashi, T.; Kajiwara, T.; Yamashita, M.; Nozaki, K. J. Am. Chem. Soc. 2009, 131, 14162-14163. doi
(8) Nozaki, K.; Aramaki, Y.; Yamashita, M.; Ueng, S.-H.; Malacria, M.;
Lacote, E.; Curran, D. J. Am. Chem. Soc. 2010, 132, 11449-11151. doi
(9) Okuno, Y.; Yamashita, M.; Nozaki, K. Angew. Chem. Int. Ed. 2011, 50, 920-923. doi
(10) Hayashi, Y.; Segawa, Y.; Yamashita, M.; Nozaki, K. Chem. Commun. 2011, 47, 5888-5890. doi
(11) Okuno, Y.; Yamashita, M.; Nozaki, K. Eur. J. Org. Chem., 2011, 3951-3958. doi
(12) Dettenrieder, N.; Aramaki, Y;. Wolf, B.; Maichle-Mo¨ssmer, C.; Zhao, X.; Yamashita, M.; Nozaki, K.; Anwander, R. Angew. Chem. Int. Ed. 2014, 53, 6259-6262. doi
(13) Kisu, H.; Sakaino, H.; Ito, F.; Yamashita, M.; Nozaki, K. J. Am. Chem. Soc. 2016, 138, 3548-3552. doi
(14) Ohsato, T.; Okuno, Y.; Ishida, S.; Iwamoto, T.; Lee, K.-H.; Lin, Z.; Yamashita, M.; Nozaki, K. Angew. Chem. Int. Ed. 2016, 55, 11426-11430. doi
(15) Asami, S.-s.; Okamoto, M.; Suzuki, K.; Yamashita, M. Angew. Chem. Int. Ed. 2016, 55, 12827-12831. doi
(16) Asami, S.-s.; Ishida, S.; Iwamoto, T.; Suzuki, K.; Yamashita, M. Angew. Chem. Int. Ed. 2017, 56, 1658-1662. doi
(17) Asami, S.-s.; Suzuki, K.; Yamashita, M. Chem. Lett. 2017, 46, 686-689. doi
(18) Yagi, A.; Kisu, H.; Yamashita, M. Dalton Trans. 2019, 48, 5496-5499. doi
(19) Kisu, H.; Kosai, T.; Iwamoto, T.; Yamashita, M. Chem. Lett. 2021, 50, 293-296. doi