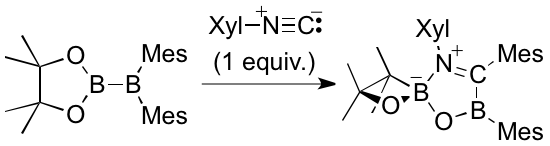(1b) 高反応性ジボラン(4)の化学
大学における化学ではホウ素の水素化物BH3はホウ素の電子不足性のために容易に二分子会合を起こして二量化し、水素原子を6個有するジボラン(6)と呼ばれる化合物B2H6を形成する。一方、同じ水素化ホウ素化合物でも、水素原子を4個しか持たないB2H4はその水素原子の個数を使ってジボラン(4)と表記されるが、ホウ素が価電子を3個しか持たないことから、ホウ素原子間にはB-B単結合が形成される。
ジボラン(4)の中で最も広く有機化学において活用されるのは、それぞれのホウ素原子に対してピナコールが結合したビス(ピナコラト)ジボラン(4), B2pin2であろう。このホウ素化合物を遷移金属錯体触媒と組み合わせて用いると、アルキンやアルケンの不飽和結合に対して2個のボリル基を導入することが可能であり、触媒の種類によってはベンゼンやアルカンのC-H結合を直接ホウ素化することが可能である。しかしこれまでにホウ素上にヘテロ原子を持たない、すなわちpπ-pπ相互作用によるホウ素の空軌道の安定化を持たないジボラン(4)の合成例は限られており、これまでにその反応性はあまり明らかになっていなかった。
我々のグループではピナコールとメシチル基が置換したジボラン(4)が高いルイス酸性と高反応性のB-B結合を同時に有することで、これまでに無い形式の反応を起こすことを明らかにしてきた。すなわち、市販のB2pin2から1段階で合成可能な非対称ジボラン(4)であるpinB-BMes2の溶液をCO雰囲気下で攪拌するとB−B結合の切断を伴って2分子のCOが反応した化合物に収束した。次に、COと等電子体であるイソニトリルとの反応を検討した。pinB-BMes2の溶液に対してtBuイソシアニドを1当量反応させると環状化合物ボラインダン誘導体が得られた。また、過剰量のイソシアニドとpinB-BMes2を反応させると、イソシアニドの配位したボラアルケンとその異性体が得られた。これらのにおいてはイソシアニドの三重結合が完全に切断されており、これは遷移金属を用いずに室温でイソニトリルの三重結合を完全に切断した最初の例となる。
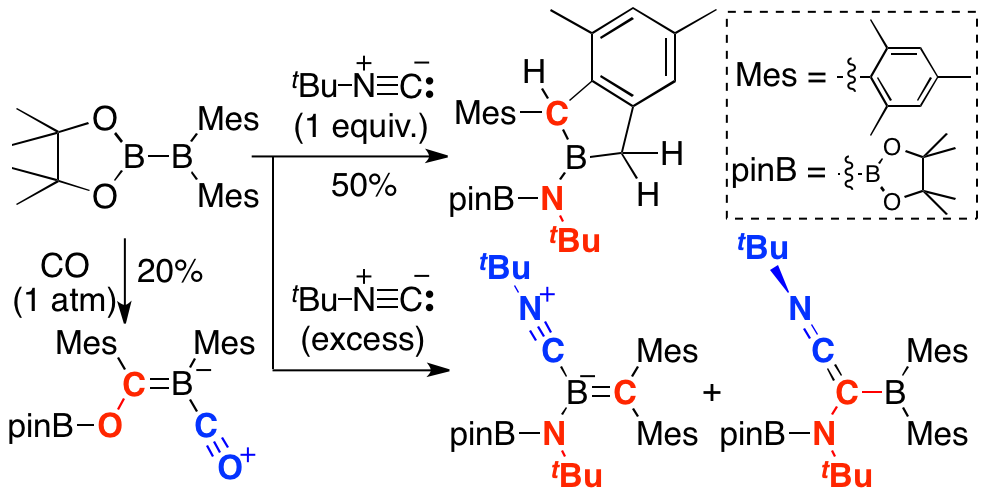
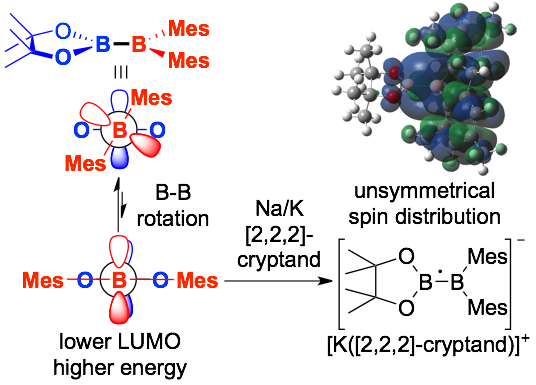
pinB-BMes2の高い反応性はその高いルイス酸性に由来することも判明した。2,2,2-cryptand存在下、pinB-BMes2をNa/Kで処理するとラジカルアニオンが濃青色結晶として得られ、その吸収は主にSOMOに関連する遷移によるものであることがDFT計算により明らかになった。このラジカルアニオンはまた、2つのホウ素原子上に非対称なスピン密度を持つことがESR測定およびDFT計算から明らかになり、2つのホウ素原子のルイス酸性の違いを反映していた。電気化学測定を行うと、このpinB-BMes2は典型的な強いルイス酸であるBMes3に比べて容易に還元を受けることも判明した。DFT計算により、B-B結合の回転時に、2つのホウ素原子が持つ空のp軌道が重なることでLUMOが低下して、この高い電子受容能を発揮していることがわかった。
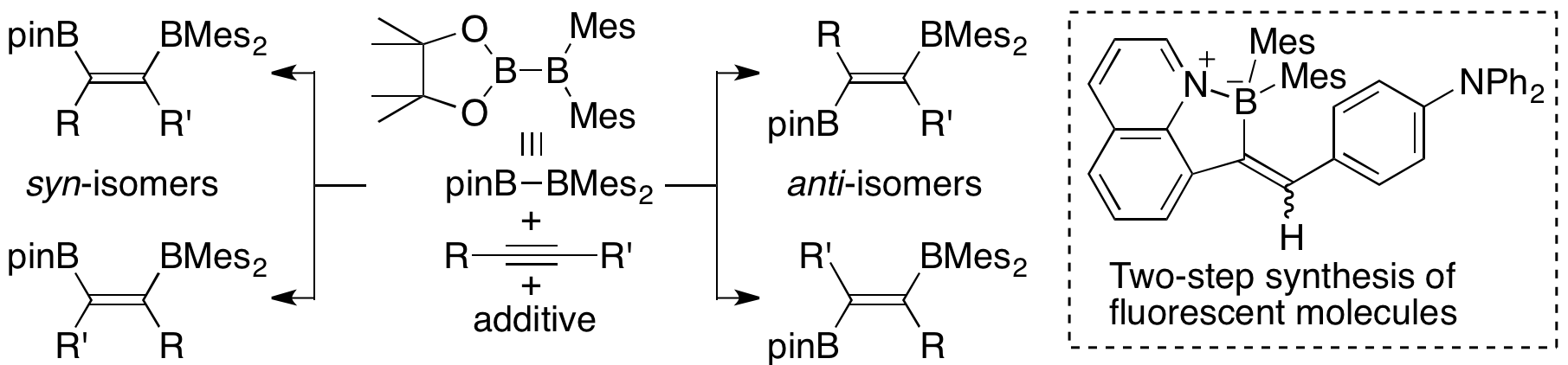
pinB-BMes2はその高い反応性故に、無触媒下でアルキンと反応することも明らかになった。pinB-BMes2をフェニルアセチレンと混合して加熱すると、対応するsyn-ジボリルアルケンの異性体混合物が得られるが、これに触媒量のnBuLiを添加するとsyn異性体の比率が逆転する。nBuLiに加えて1,2-ジメトキシエタンを添加した場合はanti-ジボリルアルケンが主生成物として得られた。反応中間体の単離およびX線結晶構造解析により反応機構を推定できている。また、この反応を利用して固体発光を示すキノリン誘導体を2段階という短工程で合成することにも成功しており、この特殊な反応を用いた有機材料化学への展開が期待される。
pinB-BMes2はまた、2,6-ジメチルフェニルイソシアニド(Xyl-NC)との反応において興味深い環縮小反応を起こすことがわかった。すなわち、pinB-BMes2を1当量のXyl-NCと反応させると、Bpin部位の五員環が環縮小反応を起こしてスピロ型の1,2-oxaboretane環を有する生成物を与えることがわかった。DFT計算によりこの反応は、多段階の転位反応を経由して進行していることも明らかとした。通常、有機合成化学において非常に安定だと考えられているBpin環が、ルイス酸性の高いBMes2部位の近くに存在すると環縮小が起こることが明らかになったため、Bpin環を含む化合物の分解経路に関する新しい知見を与える結果となるだろう。
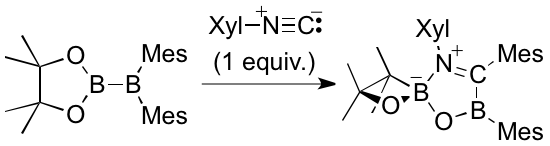
先のpinB-BMes2とイソシアニドの反応においてピリジンを共存させると、反応中間体であるボラアルケンにピリジンが配位した化合物が得られ、青色を呈することがわかった。青色の有機化合物は通常、π共役系が大きく広がった構造を有するが、この化合物は六員環芳香族置換基を4つ持つだけであり、いずれもボラアルケン平面と直交しているため共役の効果も小さいと予測される。しかしDFT計算によりボラアルケン部位からホウ素へ配位したピリジン部位への分子内電荷移動遷移が存在することが明らかとなり、特徴的な青色はこれら2つの官能基が共存するという珍しい環境がもたらしたものだとわかった。また、ピリジンを過剰量反応させた場合は、イソシアニドの当量により生成物の構造が変化するものの、ピリジンの2位のC-H結合が完璧な選択性を持って官能基化されることが明らかとなった。これはピリジンの2位選択的官能基化としても珍しい結果である。
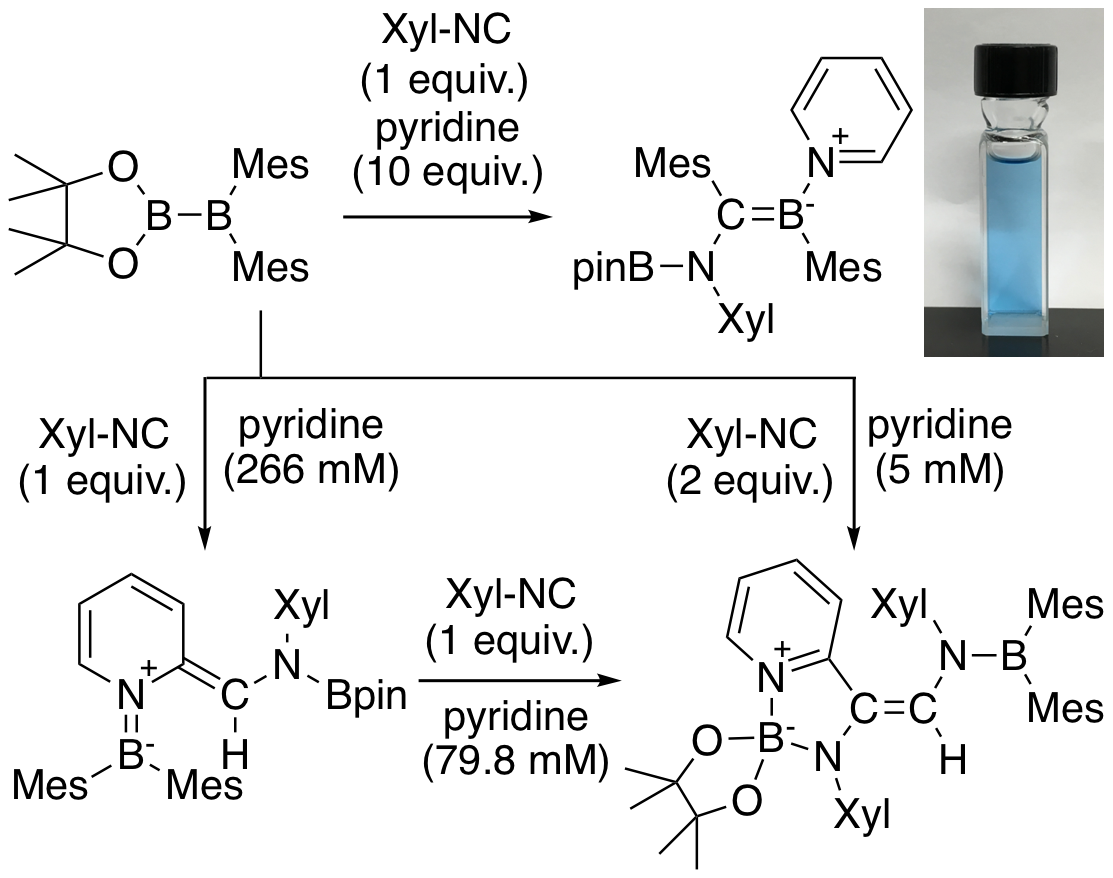
一方、我々の研究室では全ての置換基が炭素置換基であるジボラン(4)として(o-tol)2B-B(o-tol)2が簡便に合成できることを見いだした。この化合物は何の変哲もない有機ホウ素化合物であるにも関わらず、水素分子と直接反応することも明らかとなった。DFT計算によりこの反応は図示した遷移状態を経由して進行していることが明らかとなり、その電子状態を解析することで、片方のホウ素原子がルイス酸として水素分子のH-H結合電子対を受け取ると共にもう一方のホウ素原子がBrønsted塩基として水素分子から脱プロトン化を行っていることもわかった。この反応は2つのホウ素原子の空軌道が重なることによる電子受容性の高さとB-B結合の反応性の高さが共存したことにより進行したとも言える。
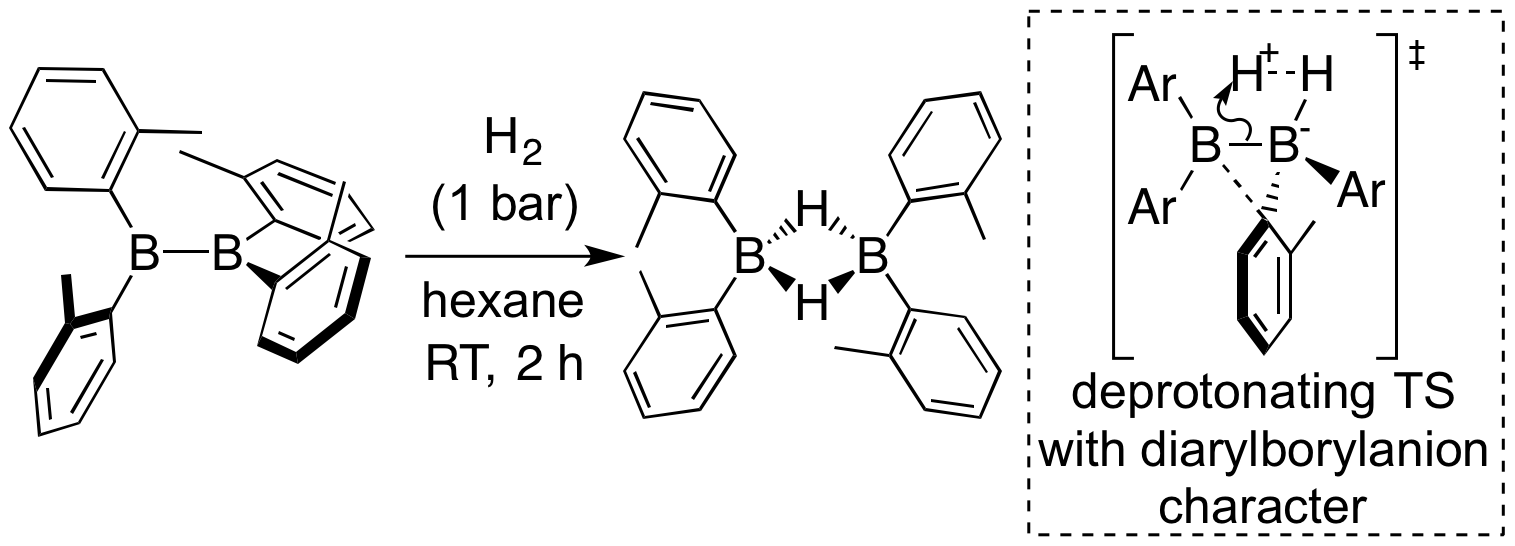
先の(o-tol)2B-B(o-tol)2はまた、一酸化炭素およびイソシアニドと反応することがわかった。前者の反応では一段階の反応で一酸化炭素のC≡O三重結合が完全に切断されると共にベンゼン環に置換したメチル基のC-H結合も切断されてボラインダンが生成する。後者の反応ではイソシアニドの置換基の種類により、イソシアニド2分子がC-C結合生成したアザアレン型生成物を与えたり、o-tolyl基の芳香族C-H結合が切断された生成物を与える。
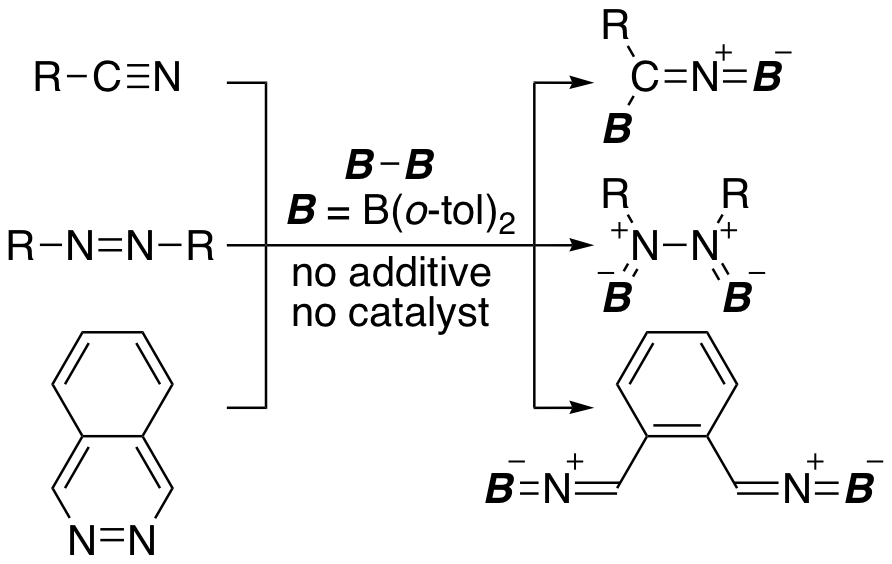
ニトリルのC≡N三重結合・アゾベンゼンのN=N二重結合・フタラジンのN=N二重結合もまた、(o-tol)2B-B(o-tol)2と反応する。ニトリルやアゾベンゼンとの反応では単純なジボリル化生成物が得られるが、フタラジンとの反応ではN=N二重結合が切断された生成物を与えた。この反応において室温では不安定な反応中間体を単離したところ、N=N二重結合への単純付加生成物であった。上の六員環が芳香族化することを駆動力として、さらにN-N単結合が切断されるという段階的な反応が進行していることが明らかとなった。
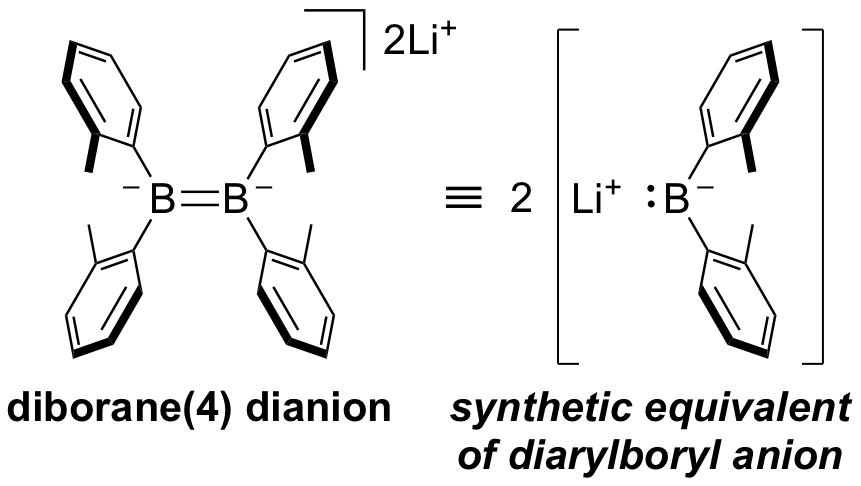
(o-tol)2B-B(o-tol)2は単体LiやMgによる2電子還元を受けてB=B二重結合を持つジアニオンが生成する。この化合物の構造および分光学的特徴は既報のものと同様であったが、その反応性には特筆すべきものがあった。このジアニオンのLi塩をジクロロメタンと反応させると見かけ上、炭素原子上でホウ素求核剤が2回反応したと見なせるジボリルメタンが生成した。単体硫黄との反応ではB2S4の六員環が生成し、この反応もホウ素求核剤が硫黄に求核攻撃して生成したと見なすことが可能である。いずれも反応機構は明らかになっていないが、このジアニオンは2当量の炭素置換ボリルアニオン等価体であることがわかった。
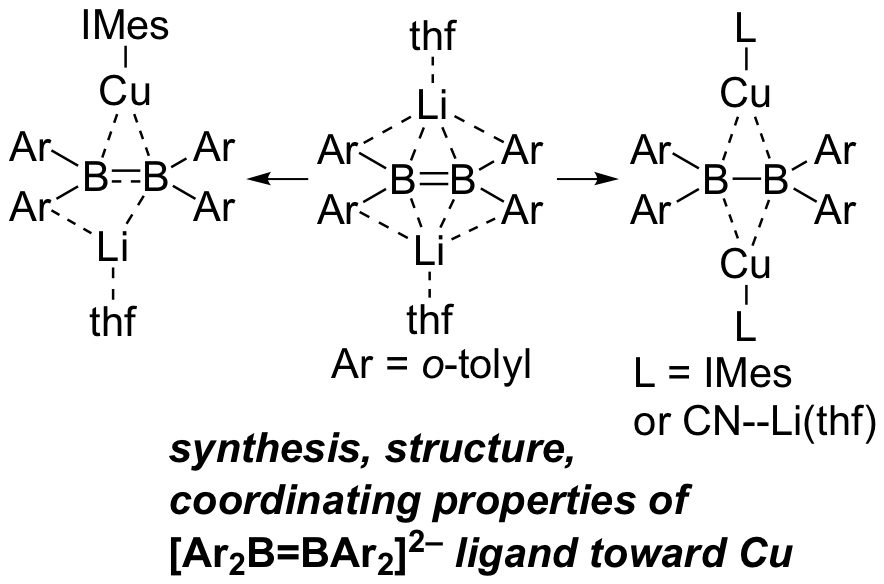
上述のジボラン(4)ジアニオンのLi塩は遷移金属に対する配位子として利用可能なこともわかった。このジアニオンを銅(I)錯体に添加すると、銅の当量に応じて単核および二核の銅錯体が得られた。NMRスペクトルやUV-vis吸収スペクトルによりこれらの錯体の電子状態を明らかにすると共に、XANESによりこの錯体の銅原子の電子密度は通常の銅(I)錯体よりも高く、ジボラン(4)ジアニオン配位子の電子供与性の高さを反映していることも見いだした。
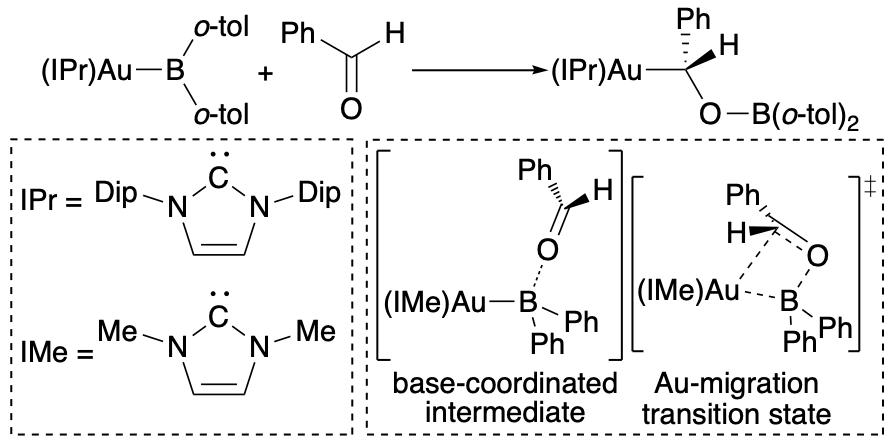
一般に遷移金属に共有結合で配位したX型配位子は求核性を示すことが知られている。それに対しこの研究では、上述の(o-tol)2B-B(o-tol)2を金アルコキシド錯体と反応させることで、炭素置換ボリル金錯体を合成し、その反応においてボリル配位子が求電子剤、金原子が求核剤であることを明らかとした。炭素置換金ボリル錯体はホウ素上にルイス酸性を示し、ピリジンやDMAPなどの中性配位子が容易に配位すること、この配位によりAu-B結合に対応するHOMOが上昇することがわかった。一方でカルボニル化合物やカルボジイミドとの反応では、それらのヘテロ原子がホウ素へ配位した後に金原子が求核的に炭素へ転位することで反応が進行してボロキシアルキル金錯体が生成することを見いだした。DFT計算によりこれらの反応機構はルイス塩基の配位により開始し、金原子の求核的転位が進行することも確認した。
発表論文
(1) Asakawa, H.; Lee, K. H.; Lin, Z.; Yamashita, M.Nature Commun. 2014, 5, 4245. doi (open access) highlighted in Nature Japan (featured article)
(2) Asakawa, H. Lee, K. H.; Furukawa, K.; Lin, Z.; Yamashita, M. Chem. Eur. J. 2015, 21, 4267-4271. doi
(3) Kojima, C.; Lee, K.-H.; Lin, Z.; Yamashita, M. J. Am. Chem. Soc. 2016, 138, 6662-6669. doi
(4) Katsuma, Y.; Asakawa, H.; Lee, K.-H.; Lin, Z.; Yamashita, M. Organometallics 2016, 35, 2563-2566. doi
(5) Tsukahara, N.; Asakawa, H.; Lee, K.-H.; Lin, Z.; Yamashita, M. J. Am. Chem. Soc. 2017, 139, 2593-2596. doi
(6) Katsuma, Y.; Asakawa, H.; Yamashita, M. Chem. Sci. 2018, 9, 1301-1310. doi
(7) Katsuma, Y.; Tsukahara, N.; Wu, L.; Lin, Z.; Yamashita, M. Angew. Chem. Int. Ed. 2018, 57, 6109-6114. doi
(8) Katsuma, Y.; Wu, L.; Lin, Z.; Akiyama, S.; Yamashita, M. Angew. Chem. Int. Ed. 2019, 58, 317-321. doi
(9) Akiyama, S.; Yamada, K.; Yamashita, M. Angew. Chem. Int. Ed. 2019, 58, 11806-11810. doi
(10) Akiyama, S.; Ikemoto, S.; Muratsugu, S.; Tada, M.; Yamashita, M. Organometallics 2020, 39, 500-504. doi
(11) Akiyama, S.; Yamashita, M. Chem. Lett. 2020, 49, 721-723. doi
(12) Suzuki, A.; Guo, X.; Lin, Z.; Yamashita, M. Chem. Sci. 2021, 12, 917-928. doi