(2b) 有機金属錯体による各種結合切断などの素反応探索
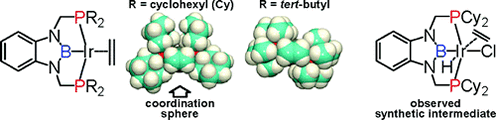
研究項目(1a)で示したように、我々はホウ素配位子を遷移金属上に求核的に導入する新規なボリル錯体合成法の開発に成功している。また、ボリル配位子を有するボリル錯体は炭化水素類のC-H結合をボリル化できることが知られており、ボリル化以外の触媒反応を行うためにボリル錯体の反応性を制御することが期待されている。しかしボリル配位子は非常に反応活性であり、金属上から容易に解離してしまう。そこで我々はホスフィン配位子を有する含ホウ素ピンサー型ボリル配位子を設計・合成した。
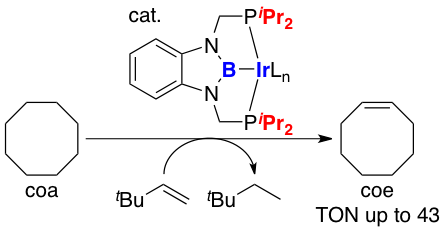
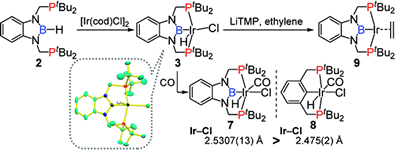
(2b-1) PBPピンサー配位子前駆体となるヒドロボラン誘導体の合成を行い、Ir金属との錯形成を行った。六配位Ir錯体の構造においてボリル配位子のトランス位にある塩素配位子とIr原子間の距離を対応するPCPピンサーIr錯体のものと比較することで、ボリル配位子の強いトランス影響を確認した。また、リン原子上のアルキル基がtBu, Cy, Phの誘導体についてはアルカンとの反応が認められなかったが、アルキル基をiPrとしたPBP-Ir錯体はアルカンの脱水素移動触媒反応に活性を示すことも明らかにした。



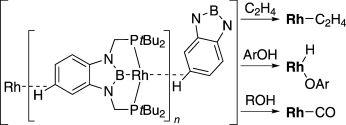
(2b-2) ヒドロボラン前駆体とRhの錯形成によりPBP-Rh(H)(Cl)およびPBP-Rh(H)(OTf)錯体を合成し、後者に強塩基を作用させるとT字型14電子Rh錯体が生成し、単離可能な固体として得られることがわかった。結晶中でこの化合物は分子間でのC-H---Rh相互作用により安定化し、鎖状構造を形成していることも明らかとなった。また、この化合物はフェノールと瞬時に反応してそのO-H結合が切断されたPBP-Rh(H)(OPh)錯体を与えることもわかった。脂肪族1,2級アルコールとの反応を行うと、一炭素減炭したアルカンとPBP-Rh(CO)錯体が生成した。一方でこの低配位型Rh錯体はシクロブタノン類のC-C単結合とも反応し、対応するロダシクロペンタノン錯体を与えることを明らかにした。これは既存のClRh(PPh3)3とシクロブタノンの反応に比べて穏和な条件で反応すると共に、生成物の位置選択性が完全に制御されることも見出している。

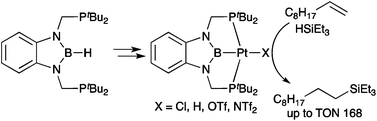
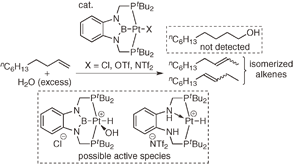
(2b-3) 同様の手法でPBP-Pt(Cl)錯体を合成し、これより誘導されるPBP-Pt(H)錯体のヒドリド配位子が1H NMRスペクトルにおいて異常な低磁場シフトを示すこと、IRスペクトルにおいて異常な低波数シフトを示すことを明らかとした。また、前者の錯体がアルケンのヒドロシリル化に対して触媒活性を示すこと、水やエタノールの存在下でPBPピンサー配位子からホウ素原子が脱離することを見いだした。
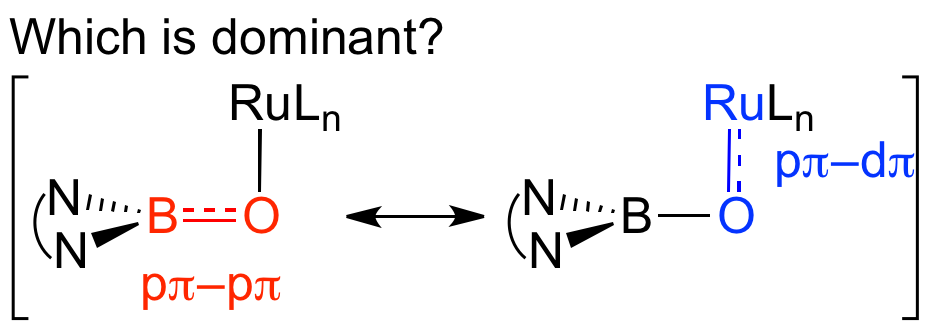
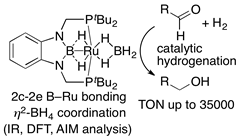
(2b-4) ヒドロボラン前駆体とRu(CO)3(cod)の反応によりPBP-Ru(H)(CO)2を合成し、これにNMOを作用させるとB-Ru結合間に酸素原子が挿入したboronato錯体が得られることを見い出した。この錯体においてはB-O結合が1.329(6) A°と非常に短いことからB=O二重結合性を持っている錯体であることもわかった。一方、異なるRu源を用いた錯形成反応によりPBP-Ru(Cl)(CO), PBP-Ru(CO)(η2-BH4), PBP(μ-H)2-Ru(OAc-κ2O), PBP(μ-H)2-Ru(η2-BH4)錯体が得られること、これらの錯体は水素ガスによるアルデヒドの水素化に対して高い触媒活性を示すことを明らかにした。
(2b-5) ネオペンチル基が置換したPNPピンサー配位子を有するIr錯体の合成と反応性の解明
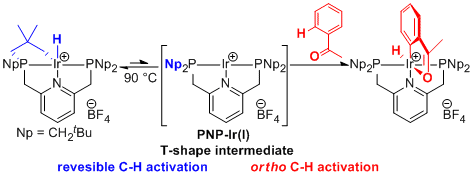
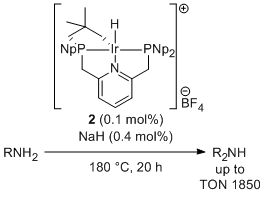
かさ高い置換基を有するピンサー型配位子をIrに導入した錯体群はC-H, N-H, O-H結合を酸化的に切断できることから注目を集めているが、一般には中心金属周りが立体的に混み合っているためこれらの結合切断を利用した触媒反応はほとんど検討されていない。我々は金属周りに空間を配置するためにネオペンチル基を有するピンサー型配位子を設計、合成し、Irと錯形成してメタラサイクルを与えることを確認した。この錯体は配位性官能基を有するアレーン類のCH活性化を起こすことに加え、アルキルアミン類からジアルキルアミン類を効率よく合成するための触媒となることが明らかになった。
1) Segawa, Y.; Yamashita, M.; Nozaki, K. J. Am. Chem. Soc. 2009, 131, 9201-9203. doi.
2) Segawa, Y.; Yamashita, M.; Nozaki K. Organometallics 2009, 28, 6234-6242. doi
3) Hasegawa, M.; Segawa, Y.; Yamashita, M.; Nozaki, K. Angew. Chem. Int. Ed. 2012, 51, 6956-6960. doi
4) Ogawa, H.; Yamashita, M. Dalton Trans. 2013, 45, 625-629 doi
5) Masuda, Y.; Hasegawa, M.; Yamashita, M.; Nozaki, K.; Ishida, N.; Murakami, M. J. Am. Chem. Soc. 2013, 135, 7142-7145. doi
6) Miyada, T.; Yamashita, M. Organometallics 2013, 32, 5281-5284. doi
7) Ogawa, H.; Yamashita, M. Chem. Lett. 2014, 43, 664-666. doi
8) Miyada, T.; Kwan, E. H.; Yamashita, M. Organometallics 2014, 33, 6760-6770. doi
9) Tanoue, K.; Yamashita, M. Organometallics 2015, 34, 4011-4017. doi
10) Yano, T.; Moroe, Y.; Yamashita, M.; Nozaki, K. Chem. Lett. 2008, 37, 1300-1301. doi
11) Yamashita, M.; Moroe, Y.; Yano, T.; Nozaki, K. Inorg. Chim. Acta 2011, 363, 15-18. doi